Interaction HB et XB
Types d’interactions
Une molécule est constituée d’un ensemble d’atomes unis par des liens covalents. Lorsque plusieurs molécules entrent en contact, des forces permettent à celles-ci de s’attirer et se regrouper jusqu’à un certain point. Ces forces, appelées forces intermoléculaires, sont toutefois plus faibles que celles impliquées dans une liaison covalente et elles sont par conséquent rompues plus facilement (tableau 1). (ref.1) Elles sont par contre assez importantes pour contribuer de façon significative à un bon nombre de propriétés physicochimiques de la matière.
| kJ/mol | Kcal/mol | Directionality | ||
|---|---|---|---|---|
| Forces Intramoléculaires
(forces entre les atomes) |
Liaison covalente | 150-1100 | 35-260 | oui |
| Forces Intermoléculaires
(forces entre les molécules) |
Liaison hydrogène-HB
(pont H, Hydrogen bridge, Hydrogen Bond ou HB) |
4-50 | 1-12 (0.5 à 40) | oui |
 |
||||
| Liaison halogène-HX
(Halogen Bond ou HX) |
4-50 | 1-12 (0.5 à 40) | oui | |
| Autres interactions faibles
(Debye, London, etc.) |
<1-25 | <1-6 | non | |
| Forces Intramoléculaires
(forces entre les atomes) |
|
| Liaison covalente | |
| kJ/mol | Kcal/mol |
|---|---|
| 150-1100 | 35-260 |
| Directionality | |
| oui | |
|
Forces Intermoléculaires
(forces entre les molécules) |
|
| Liaison hydrogène-HB (pont H, Hydrogen bridge, Hydrogen Bond ou HB) | |
| kJ/mol | Kcal/mol |
|---|---|
| 4-50 | 1-12 (0.5 à 40) |
| Directionality | |
| oui | |
 |
|
Liaison halogène-HX
(Halogen Bond ou HX) |
|
| kJ/mol | Kcal/mol |
|---|---|
| 4-50 | 1-12 (0.5 à 40) |
| Directionality | |
| oui | |
|
Autres interactions faibles
(Debye, London, etc.) |
|
| kJ/mol | Kcal/mol |
|---|---|
| <1-25 | <1-6 |
| Directionality | |
| non | |
Tableau 1. Comparaison des forces de liaisons intramoléculaires et intermoléculaires (valeurs approximatives).
Une particularité des deux plus grandes forces intermoléculaires (la liaison hydrogène et la liaison halogène) réside dans leur caractère directionnel (ce qui n’est pas le cas pour les forces de London par exemple). Ainsi, les molécules de la matière qui subissent ce type d’interactions ont tendances à s’aligner entre elles pour favoriser, autant que cela est possible, leur géométrie de contact (angle, distance). Ces forces directionnelles permettent parfois de créer des matériaux avec des propriétés uniques, comme par exemple le Kevlar, dans laquelle des ponts H alignent les chaînes de polymères de façon régulière pour former un réseau de fibres, ce qui confère au Kevlar une grande rigidité.
Définition du pont H
La définition classique du pont H (Hydrogen Bond, HB) encore largement utilisé dans les volumes collégiaux et universitaires découle en 1997 du IUPAC Compendium of Chemical Terminology 2nd Edition (en français : l'UICPA (Union Internationale de Chimie Pure et Appliquée)).
Définition actuelle du pont H selon l’IUPAC Compendium of Chemical Terminology 2nd Edition (1997)
‘’A form of association between an electronegative atom and a hydrogen atom attached to a second, relatively electronegative atom.[…]Both electronegative atoms are usually (but not necessarily) from the first row of the Periodic Table, i.e. N, O or F. Hydrogen bonds may be intermolecular or intramolecular. With a few exceptions, usually involving fluorine, the associated energies are less than 20 - 25 kJ mol −1 (5 - 6 kcal mol −1).’’ (ref.1)
Par contre, plusieurs observations faites par les chimistes confirment que la définition doit être revue afin d’incorporer un plus large éventail de ponts H. Il faut savoir ainsi que depuis 2005, des recommandations ont été faites à l’IUPAC dans le but de décrire entre autre des ponts H ‘’non-conventionnels’’ souvent plus faibles que les ponts H classiques (ou inversement plus forts).
‘’A form of association between an electronegative atom and a hydrogen atom attached to a second, relatively electronegative atom.[…]Both electronegative atoms are usually (but not necessarily) from the first row of the Periodic Table, i.e. N, O or F. Hydrogen bonds may be intermolecular or intramolecular. With a few exceptions, usually involving fluorine, the associated energies are less than 20 - 25 kJ mol −1 (5 - 6 kcal mol −1).’’ (ref.1)
Par contre, plusieurs observations faites par les chimistes confirment que la définition doit être revue afin d’incorporer un plus large éventail de ponts H. Il faut savoir ainsi que depuis 2005, des recommandations ont été faites à l’IUPAC dans le but de décrire entre autre des ponts H ‘’non-conventionnels’’ souvent plus faibles que les ponts H classiques (ou inversement plus forts).
Définition proposée pour le pont H selon les recommandations à IUPAC à partir de 2005
‘’The hydrogen bond is an attractive interaction between a hydrogen atom from a molecule or a molecular fragment X–H in which X is more electronegative than H, and an atom or a group of atoms in the same or a different molecule, in which there is evidence of bond formation.‘’ (ref.1) , (ref.2)
Dans cette nouvelle définition, l’atome X n’est pas restreint aux atomes O, N ou F, car, par exemple, un atome de C est aussi un atome plus électronégatif qu’un H. On peut ainsi avoir des ponts H non-conventionnel comme C-H…O (plus faible). L’évidence de la présence du pont H peut être décrite par exemple par la formation d’un contact qui est inférieure à la somme des interactions de vDW des atomes impliqués et aussi par le caractère directionnel (exemple : un angle qui tend vers 180o). En étudiant les banques de données cristallographiques, on peut apercevoir ces tendances. (ref.1) Cette nouvelle définition du pont H élargie le domaine d’interactions de celui-ci à des énergies allant de 0.5 à 40 kcal/mol. (ref.2), (ref.3)
Dans cette nouvelle définition, l’atome X n’est pas restreint aux atomes O, N ou F, car, par exemple, un atome de C est aussi un atome plus électronégatif qu’un H. On peut ainsi avoir des ponts H non-conventionnel comme C-H…O (plus faible). L’évidence de la présence du pont H peut être décrite par exemple par la formation d’un contact qui est inférieure à la somme des interactions de vDW des atomes impliqués et aussi par le caractère directionnel (exemple : un angle qui tend vers 180o). En étudiant les banques de données cristallographiques, on peut apercevoir ces tendances. (ref.1) Cette nouvelle définition du pont H élargie le domaine d’interactions de celui-ci à des énergies allant de 0.5 à 40 kcal/mol. (ref.2), (ref.3)
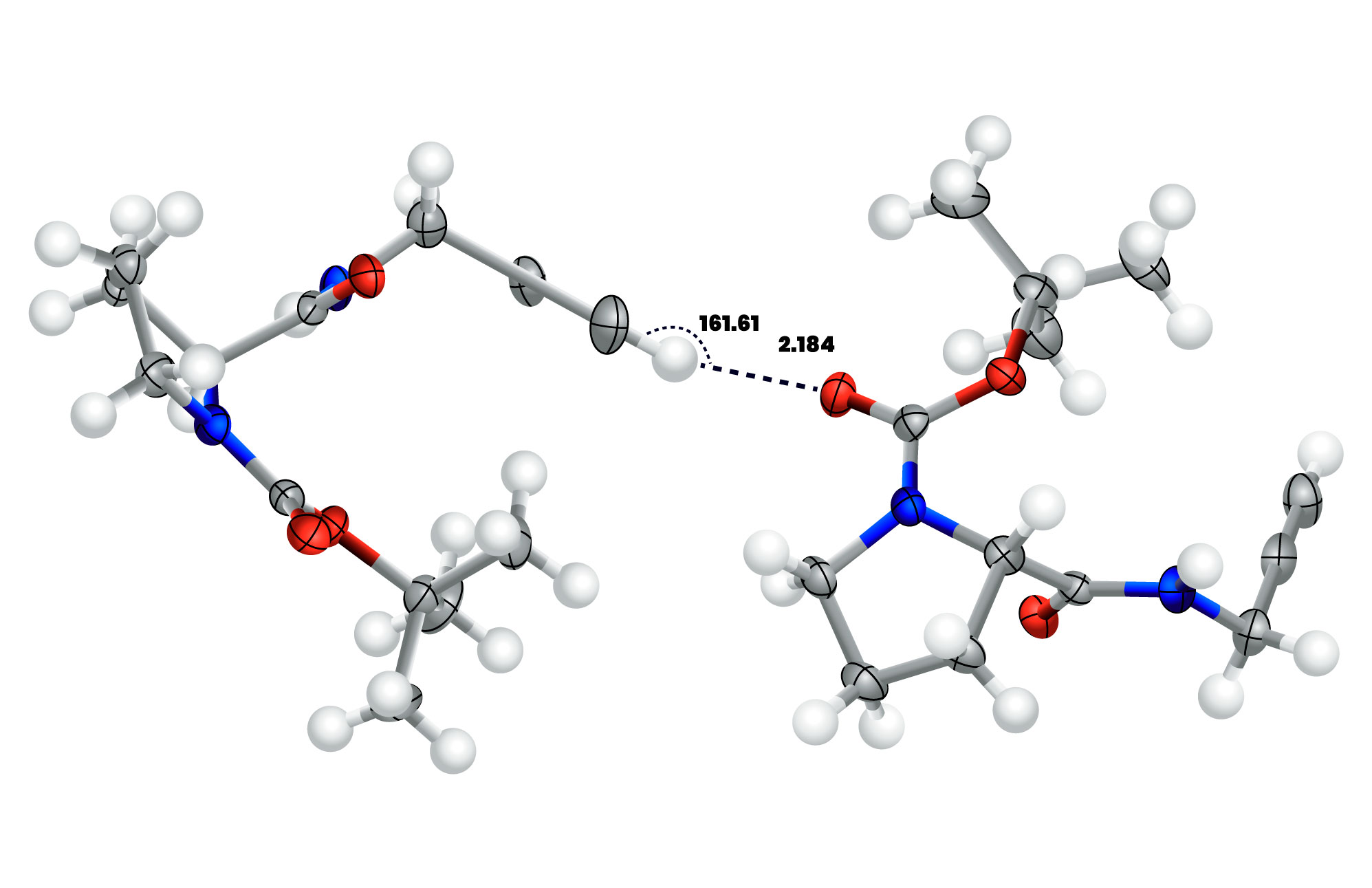
Figure 1. Interaction pont H non-conventionnel observé dans les cristaux d’un dérivé de la proline. (ref.1) L’angle C-H…O de 162o est près de la linéarité (180o) et la distance H…O (∼2.2Å) est inférieure à la somme des rayons de vDW de H et O (1.20Å (pour H) + 1.52Å (pour O) ≅ 2.72Å).
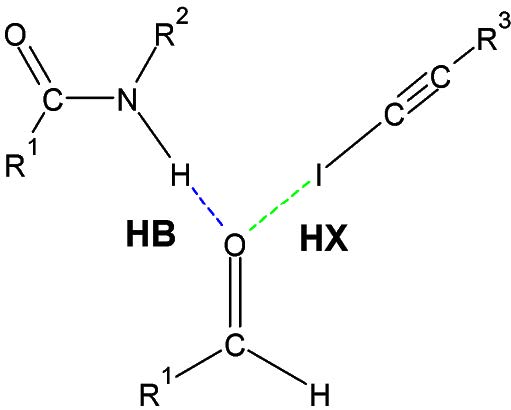
DÉFINITION DE LA LIAISON HALOGÈNE
Étrangement similaire à la liaison hydrogène (figure 1), la liaison halogène est pourtant méconnue et absente des volumes de chimie du collégial et du cycle universitaire. Nous sommes les premiers auteurs à inclure une capsule dans un volume de chimie organique au Québec. La raison est qu’il est contre-intuitif de penser qu’un atome halogène (un atome relativement électronégatif) puisse avoir une région électrophile et ainsi agir dans une interaction similaire au pont H.
La présence de l’interaction halogène dans la littérature scientifique a été ainsi plus discrète et a été plus tardive que dans le cas du pont H. Les travaux de Politzer et Murray dans les années 1990 ont apporté une contribution significative en décrivant la région électrophile impliquée dans une liaison halogène, région que l’on nomme le trou sigma (figure 2). (ref.1)
La présence de l’interaction halogène dans la littérature scientifique a été ainsi plus discrète et a été plus tardive que dans le cas du pont H. Les travaux de Politzer et Murray dans les années 1990 ont apporté une contribution significative en décrivant la région électrophile impliquée dans une liaison halogène, région que l’on nomme le trou sigma (figure 2). (ref.1)
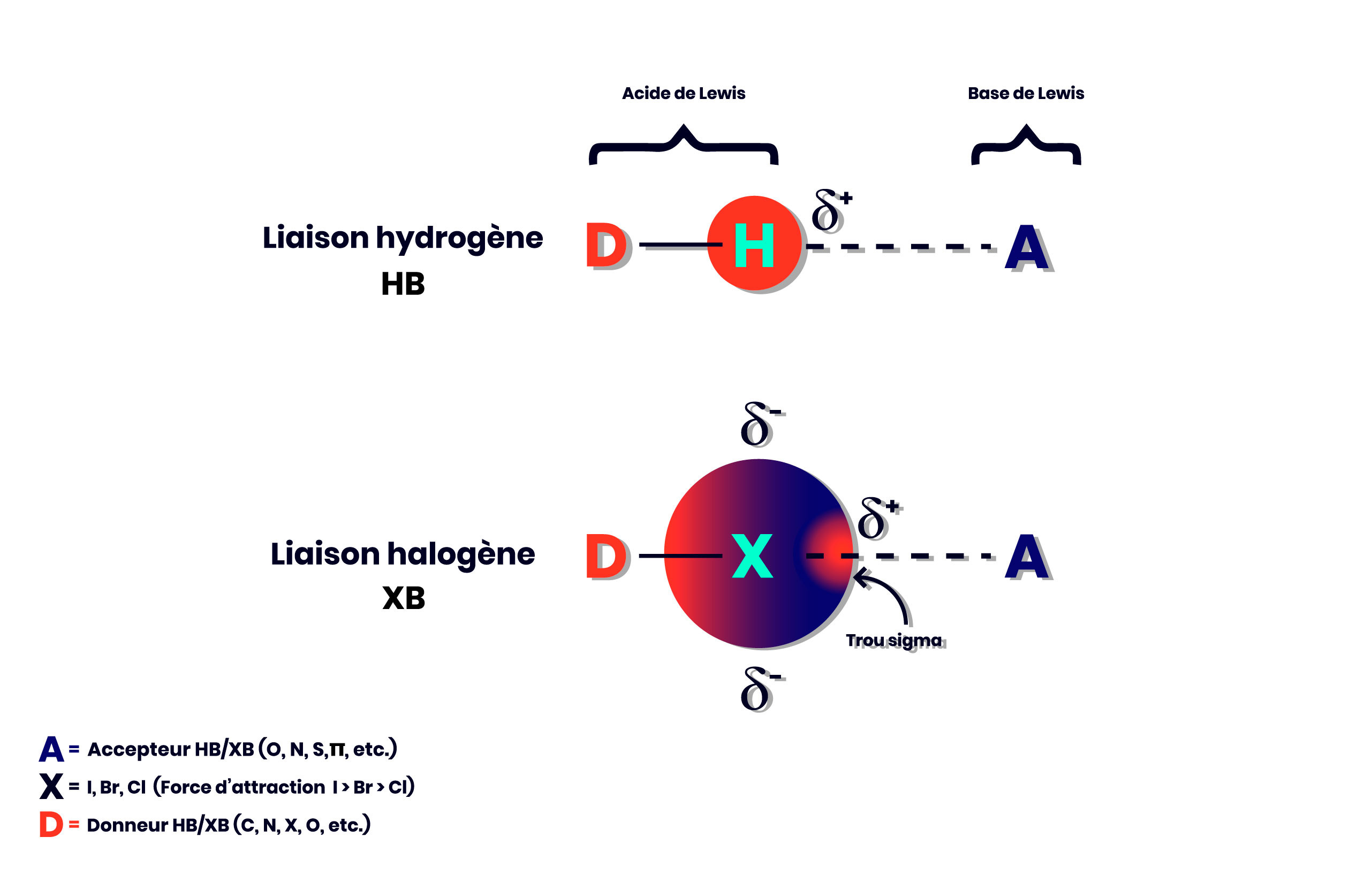
Figure 2. Comparaison du pont H et de la liaison halogène.
Tout comme le pont H, les énergies impliqués peuvent être très variables allant par exemple de 10kJ/mol (exemple un contact N···Cl) (ref.1) à 150 kJ/mol (exemple un contact I2···I–). (ref.2)
Il n’y a actuellement pas encore de définition officielle de l’IUPAC, mais bien une recommandation de 2013 qui a pris naissance lors d’un projet qui a débuté en 2009. Ce projet a été initié par le groupe de l’IUPAC afin de mieux comprendre et classifier les interactions intermoléculaires impliquant les atomes d’halogènes. (ref.3)
Il n’y a actuellement pas encore de définition officielle de l’IUPAC, mais bien une recommandation de 2013 qui a pris naissance lors d’un projet qui a débuté en 2009. Ce projet a été initié par le groupe de l’IUPAC afin de mieux comprendre et classifier les interactions intermoléculaires impliquant les atomes d’halogènes. (ref.3)
Définition proposée pour la liaison halogène selon les recommandations IUPAC de 2013 (ref.1)
‘’A halogen bond occurs when there is evidence of a net attractive interaction between an electrophilic region associated with a halogen atom in a molecular entity and a nucleophilic region in another, or the same, molecular entity.‘’ (ref.2)
‘’A halogen bond occurs when there is evidence of a net attractive interaction between an electrophilic region associated with a halogen atom in a molecular entity and a nucleophilic region in another, or the same, molecular entity.‘’ (ref.2)
Par contre, malgré les similitudes avec le pont H, on peut faire ressortir quatre différences entre la liaison halogène et cette dernière. (ref.1)
- Les liaisons halogènes tendent à être plus directionnelles que les ponts H.
- Dans le cas des liaisons halogènes, on peut faire varier la force de l’interaction. Dans l’ordre, les atomes d’halogène les plus polarisables (I>Br>Cl) forment les liens les plus forts.
- Les liaisons halogènes sont hydrophobes contrairement aux ponts H qui sont hydrophiles.
- La taille de l’atome d’halogène est considérablement plus grande qu’un atome de H, ce qui permet d’offrir aux chimistes plus de possibilités dans l’éventuelle conception de matériaux fonctionnels. D’un autre côté, l’encombrement dû à la grosseur de l’atome peut parfois être nuisible.